传染性法氏囊的病原学与免疫应答
发布时间:2025-02-18 发布人:华南生物 分类:技术专栏
传染性法氏囊病是由双RNA病毒科的禽双RNA病毒属的传染性法氏囊病毒(IBDV)引起的一种高度传染性的疾病,呈急性并伴有严重免疫抑制,主要影响青年鸡,造成重大的经济影响。该病于1957年首次爆发,1962年美国正式报告。早期该病的特点是广泛性的肾脏损伤,当时被称为禽肾病。该病造成的巨大经济损失来源于两个因素,它通过破坏法氏囊中含有IgM的发育中的B淋巴细胞,造成严重的免疫抑制,降低体液免疫应答能力,使鸡只更易受到感染,并易导致疫苗接种失败;3周龄或青年鸡,出现60%以上的死亡率。该病潜伏期短,约3-5天,小于3周龄的鸡没有临床症状,但导致免疫抑制。IBDV导致的免疫抑制程度,取决于感染鸡的年龄,2周龄的鸡比大日龄的鸡免疫抑制更严重。
一、基因组结构和病原学
传染性法氏囊病毒的基因组为分段的双链RNA(dsRNA),片段分为A和B,病毒粒子55-60nm,无囊膜,二十面体对称衣壳。B片段较小,编码病毒蛋白1(VP1,95kDa)。A片段(2.9kb-3.4kb)具有两个部分重叠的开放阅读框(ORF)。其中,较小的ORF编码非结构蛋白VP5(17kDa),该蛋白与病毒的致病性和病毒在细胞间传播有关;较大的ORF编码一个110kDa的多聚蛋白,通过自裂解产生3个多肽:pVP2(48kDa)、VP3(32kDa)、VP4(28kDa)。VP4作为一种具有丝氨酸-赖氨酸蛋白酶活性的蛋白,介导了这一过程。
VP1蛋白是RNA依赖的RNA聚合酶,在病毒粒子中以游离的形式存在,并且该基因组连接蛋白(VPg)附着在两个基因组片段的正链的5’端。研究表明,超强毒vvIBDV致病型的VP1基因序列形成了一个独特的簇,表明它可能来自于B片段的基因重组。VP1蛋白由于其在病毒复制效率中的作用而调节病毒毒力,通过针对VP1蛋白的RNA(DNA载体为基础)体外干扰实验来抑制病毒复制。
外衣壳蛋白VP2是主要结构蛋白,约占病毒总蛋白的51%(Heetal, 2009)。它至少有2个中和表位,可诱导产生中和抗体。它负责抗原变异、适应组织能力和病毒毒力。VP2成熟过程中的2种短肽产物在病毒附着和胞浆内易位期间,决定病毒颗粒在细胞质膜的组装和破坏过程。蛋白质被折叠成三个关键的结构域:基底、外壳和突起。VP2并不是超强毒中唯一的毒力决定因素,VP1蛋白是另一个毒力决定因素(Qi等,2013)。
内衣壳蛋白VP3(32kDa)是Y型三聚体,约占病毒总蛋白的40%,形成病毒蛋白组装的衣壳内部支架。它具有群特异性和少量的中和抗原表位,与VP1相互作用,通过其羧基末端结构域与病毒基因组物质相互作用。有学者认为,VP3蛋白通过与病毒颗粒的几乎所有成分(自身、VP2、VP1和两个基因组dsRNA)的相互作用,促进病毒复制和子代病毒的产生。
VP4(28kDa)是一种病毒自催化蛋白酶,是一种可溶性蛋白,它利用不含ATP酶结构域的丝氨酸-赖氨酸催化二元体,将多聚蛋白裂解为单独的VP2、VP3和VP4蛋白。VP4在IBDV血清型和毒株中是保守的。该蛋白通过在组装过程中不断修饰C端末梢几个小肽,在pVP2蛋白的成熟过程中发挥重要作用。
病毒非结构蛋白VP5是一种II类膜蛋白,具有细胞质N端和细胞外C端结构域。它在所有的IBDV血清1型株中具有强碱性和半保守性,并富含半胱氨酸。VP5可诱导法氏囊病变,在病毒传播和释放中发挥重要作用。该蛋白在细胞膜内积累,导致细胞活力下降。在体外培养中,VP2与VP5可诱导细胞凋亡。
二、抗原漂移和基因组RNA突变
外衣壳蛋白VP2可诱导产生中和抗体。VP2上抗原表位所在的区域具有高核苷酸变异性,表明其易受抗原转换和漂移的影响。研究表明,超强毒vvIBDV的毒力、组织嗜性和致病表型的决定因素是由VP2蛋白中253、279、284位的一些氨基酸残基控制的。反向遗传学研究数据表明,VP2高变区内253位氨基酸或任何其他氨基酸的单一突变足以改变IBDV的毒力。在从接种了经典株疫苗的鸡群中分离出来的vvIBDV中,观察到G254D的甘氨酸-丝氨酸突变,因此该突变可能导致疫苗接种失败。流行病学发现一个全新的独特株,其在VP2高变区具有独特的AA序列272T、289P及在VP1中234P位,这些序列是保守的,根据分子特征和致病性,将其称为新型IBDV(dIBDV),广泛分布在南美、欧洲、亚洲。
基于IBDV VP2分子流行病学的遗传多样性,学者建议采用新的分类法,将其分为7个基因型。一些基因型具有全球分布性,如基因1型(caIBDV)和基因3型(vvIBDV及其重组株)的成员,而基因2型(美洲发现的vaIBDV)、基因4型(南美洲发现的dIBDV)和基因5型(墨西哥发现,被认为是caIBDV和vaIBDV的重组株)的成员呈区域性分布。基因6型来自中东(沙特),与意大利的ITA基因型有92-93%的相关性,与俄罗斯的IBDV RF-5/94株有94-95%的相关性。基因7型的成员主要来自澳大利亚和少数俄罗斯。
三、血清型和致病型
IBDV在抗原上分为血清1型和血清2型。血清2型主要感染火鸡,对鸡无毒力,对血清1型也不能提供交叉保护。血清1型对鸡具有不同致病性,这源于毒力、免疫抑制和抗原性的不同。早期的IBDV疫情主要是经典株(caIBDV)引起的,法氏囊炎症、肿大,然后萎缩。20世纪80年代初,在美国、中美洲和澳大利亚出现变异株(vaIBDV),它在抗原上不同于经典株或超强毒株,只引起法氏囊萎缩,没有炎症。80年代末,西欧、东南亚和非洲出现的超强毒株(vvIBDV),特征是法氏囊肿大,然后萎缩,其毒力比经典株更强,死亡率超过70%。经典株和超强毒株会引起出血性炎症,并伴有严重的法氏囊滤泡损耗,两者仅在死亡率上有所不同(caIBDV为30-60%,vvIBDV为70-100%)。而变异株导致法氏囊快速萎缩,没有炎症、出血,死亡率10%以下或没有。接种过caIBDV疫苗的鸡群,仍然会感染变异株。变异株和超强株,以及最近新型IBDV(dIBDV)可以突破母源抗体,并感染青年鸡,蛋雏鸡死亡率高达60%,肉仔鸡死亡率达25%。超强株虽然与经典株具有抗原相似性,但是经典株母源抗体很高的鸡群,仍然会感染超强毒株。
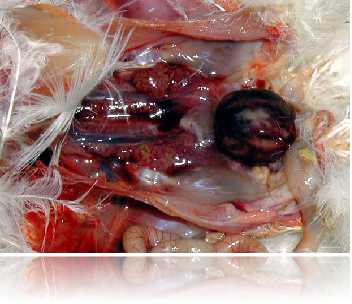
法氏囊出血
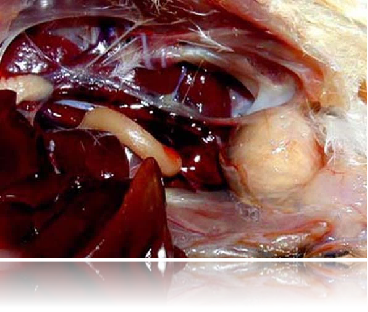
法氏囊肿大
目前,IBD疫苗主要是灭活苗或活疫苗。种鸡接种了灭活苗或减毒活疫苗,雏鸡通过母源抗体就获得对IBD的保护。然而,母源抗体会干扰减毒活疫苗的有效性,除非使用中等毒力疫苗和强毒疫苗,这样会造成疫苗引起的法氏囊损伤,导致免疫抑制。因此,迫切需要开发安全有效的疫苗,甚至在母源抗体存在的情况下,也能诱导正确的免疫应答。
四、先天免疫应答
实验发现,使用变异株开发的减毒活疫苗和灭活疫苗,都对感染经典株或变异株的鸡具有交叉保护作用;而使用经典IBDV株开发的疫苗部分保护或不能保护变异株的感染。
基因表达研究表明,急性感染IBDV,激活了法氏囊T细胞和脾脏巨噬细胞。法氏囊细胞被耗尽,与NK细胞、巨噬细胞和T细胞激活相关的基因上调,这些基因包括干扰素、白介素和MIP-1,以及调节先天免疫系统的基因,如MD-1、MD-2、补体、热休克蛋白,以及炎性和促炎反应基因。
IBDV感染过程中先天免疫应答的遗传调控
IBDV经口感染后的8-12小时,可在肠道的单核巨噬细胞中检测到,然后这些细胞将病毒转运到法氏囊,在带IgM的B细胞内进行有效的病毒复制。感染激活NF-kB通路和其他细胞内信号通路。巨噬细胞大量浸润法氏囊可诱导促炎介质如白介素的大量表达。在IBDV的研究中,观察到中枢淋巴器官中IFN、趋化因子、补体成分、防御素的高表达。实验研究发现,NK细胞可能参与了IBDV的感染发病和先天免疫应答。
李小庆
2023.03.08
